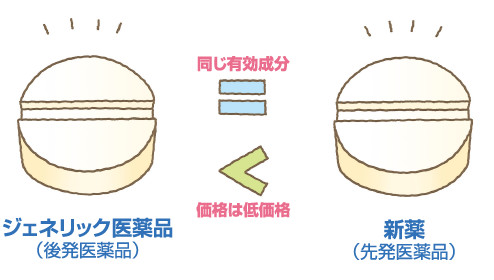
欧米ではブランド名が使用されているのは、新薬(先発医薬品)だけであり、後発医薬品は有効成分の一般名(generic name)が使用されています。そのため、日本でも後発医薬品=ジェネリック医薬品と呼ばれるようになりました。
ジェネリック医薬品は新薬に比べて開発に要するコストがかからないため、新薬と同じ有効成分でありながら、新薬に比べて低価格で提供することができます。
※薬によっては、価格の差が小さく薬代があまり変わらない場合があります。


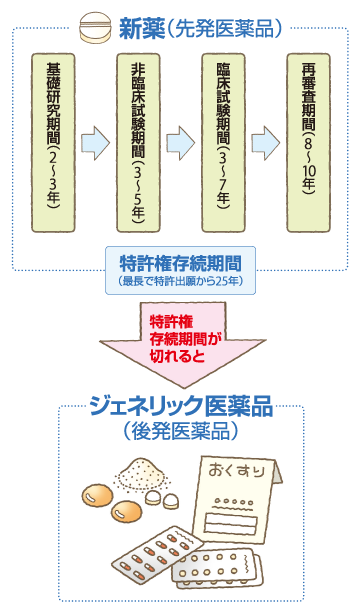
医薬品の特許とは?
有効成分に対する「物質特許」、製造工程に対する「製法特許」、物質の用途に対する「用途特許」などがあります。新薬は、長い研究期間をかけて新しい成分の有効性・安全性が確認された後、国の承認を受けて発売される薬です。

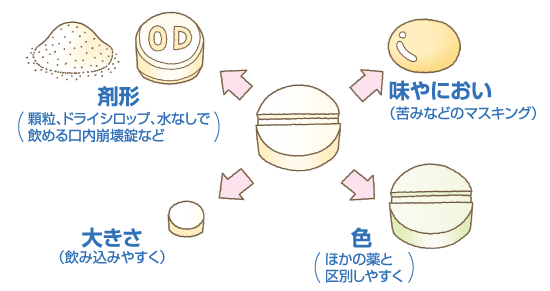
それぞれの製薬会社によって、大きさや味、においなどを改良して飲みやすくする工夫がされていることがあります。もちろん、飲み薬だけでなく点鼻薬や点眼薬など外用薬もいろいろ工夫されているものがあります。

ジェネリック医薬品(後発医薬品)に対して、多くの方が抱くさまざまな疑問にお答えします。
 先発医薬品と本当に同じ?
先発医薬品と本当に同じ?ジェネリック医薬品(後発医薬品)は、先発医薬品とは使用する添加剤が違うのだから、先発医薬品と同じと言えないのではないか?
 ジェネリック医薬品と先発医薬品とは、有効性や安全性について基本的に違いはありません。ジェネリック医薬品が先発医薬品と異なる添加剤を使用する場合も、先発医薬品が上市後に添加剤を変更する場合と同様に、添加剤の違いによって有効性・安全性に違いがないことを確認しています。
ジェネリック医薬品と先発医薬品とは、有効性や安全性について基本的に違いはありません。ジェネリック医薬品が先発医薬品と異なる添加剤を使用する場合も、先発医薬品が上市後に添加剤を変更する場合と同様に、添加剤の違いによって有効性・安全性に違いがないことを確認しています。
 ジェネリック医薬品(後発医薬品)は、先発医薬品と同一の有効成分を同一量含有しており、効能・効果や用法・用量も基本的には変わりません。先発医薬品と治療学的に「同等」であり、先発医薬品と代替可能な医薬品であることを、必要なデータに基づいて審査を行ったうえで厚生労働大臣が承認したものだけが、ジェネリック医薬品として供給されているのです。
ジェネリック医薬品(後発医薬品)は、先発医薬品と同一の有効成分を同一量含有しており、効能・効果や用法・用量も基本的には変わりません。先発医薬品と治療学的に「同等」であり、先発医薬品と代替可能な医薬品であることを、必要なデータに基づいて審査を行ったうえで厚生労働大臣が承認したものだけが、ジェネリック医薬品として供給されているのです。しかし、ジェネリック医薬品は、先発医薬品と全く「同じ」である必要はありません。例えば、先発医薬品が製剤特許を有している場合などは、ジェネリック医薬品は先発医薬品と異なる添加剤を使用することがあります。
先発医薬品と異なる添加剤を使用する場合であっても、日本薬局方の製剤総則の規定により、薬理作用を発揮したり、有効成分の治療効果を妨げたりする物質を添加剤として使用することはできません。使用前例のある、安全性が確認された添加剤のみが使用されています。仮に、使用前例の無い添加剤を医薬品に使用する場合には、その添加剤の毒性試験などを実施してあらためて安全性等の審査を受けなければなりません。
添加剤の成分や配合量が先発医薬品と異なっていても、有効性や安全性に違いが出ることがないように、ジェネリック医薬品の承認審査においては、生物学的同等性試験のデータの提出を求めて、主成分の血中濃度の挙動が先発医薬品と同等であることを確認しています。
患者さんの体質によっては、添加剤が原因でアレルギー反応などの副作用等を引き起こすことがまれにありますが、これは、先発医薬品であってもジェネリック医薬品であっても、同様に起こりうることです。
 なお、既に上市されている先発医薬品でも、承認を受けた当初の製剤と異なる添加剤への変更がなされる場合があります。(すなわち、同じ銘柄の先発医薬品でも、例えば10年前の製品と現在流通している製品とで添加剤が異なるケースがあります。)こうした場合についても、生物学的同等性試験によって、当初の製剤(標準となる先発医薬品)と添加剤を変更した後の先発医薬品とで有効性、安全性が変化していないことを、ジェネリック医薬品と同じ方法で確認をしています。米国のジェネリック医薬品は先発医薬品と必ず同じ添加剤を使用している、という話を聞くことがありますが、これは完全な誤解であり、そのような事実はありません。
なお、既に上市されている先発医薬品でも、承認を受けた当初の製剤と異なる添加剤への変更がなされる場合があります。(すなわち、同じ銘柄の先発医薬品でも、例えば10年前の製品と現在流通している製品とで添加剤が異なるケースがあります。)こうした場合についても、生物学的同等性試験によって、当初の製剤(標準となる先発医薬品)と添加剤を変更した後の先発医薬品とで有効性、安全性が変化していないことを、ジェネリック医薬品と同じ方法で確認をしています。米国のジェネリック医薬品は先発医薬品と必ず同じ添加剤を使用している、という話を聞くことがありますが、これは完全な誤解であり、そのような事実はありません。

 普及が急がれる理由は?
普及が急がれる理由は?世界で最も進んでいると言われる日本の医療の中で、どうしてわざわざジェネリック医薬品を普及させる必要があるのか?
 世界で最も優れていると言われる日本の医療の質を落とすことなく、国民皆保険制度を今後も持続させていくためには、ジェネリック医薬品の使用促進により医療資源の効率的活用を図ることが必要です。
世界で最も優れていると言われる日本の医療の質を落とすことなく、国民皆保険制度を今後も持続させていくためには、ジェネリック医薬品の使用促進により医療資源の効率的活用を図ることが必要です。
 日本の医療保険制度は、昭和36(1961)年に「国民皆保険」を達成して以来、一定の自己負担で必要な医療サービスが受けられる体制を整備することにより、世界最長の平均寿命や高い保険医療水準を達成してきました。しかし、それから半世紀が経過した今日においては、急速な高齢化の進展等、医療を取り巻く環境は大きく変化しており、医療保険財政の厳しさが続く中で、今後とも必要な医療を確保しつつ、人口構造の変化に対応できる持続可能なシステムを作り上げていく必要があります。
日本の医療保険制度は、昭和36(1961)年に「国民皆保険」を達成して以来、一定の自己負担で必要な医療サービスが受けられる体制を整備することにより、世界最長の平均寿命や高い保険医療水準を達成してきました。しかし、それから半世紀が経過した今日においては、急速な高齢化の進展等、医療を取り巻く環境は大きく変化しており、医療保険財政の厳しさが続く中で、今後とも必要な医療を確保しつつ、人口構造の変化に対応できる持続可能なシステムを作り上げていく必要があります。近年の国民医療費の動向を見ると、その支出は国民所得の伸びを上回る勢いで増えています。平成21(2009)年度の国民医療費は約36兆円、前年度と比べると1年間で約1.2兆円増加しています。国民所得のうち医療費が約10.6%を占めています。
10年前の平成11年度の時点では、医療費が約31兆円、国民所得に占める割合は8.4%でした。わずか10年の間に医療費の総額も、国民所得に占める割合も、大幅に増えていることになります。
医療技術の進歩や高齢化等により、今後も医療費の上昇が見込まれる中、国民皆保険を堅持していくためには、必要な医療を確保した上で、効率化できる部分は効率化を図ることが重要です。
ジェネリック医薬品は、先発医薬品と治療学的に同等であるものとして製造販売の承認がなされた医薬品でありながら、開発費用を低く抑えられることから、低価格での供給が可能であり、高価な先発医薬品と代替可能な医薬品と位置づけることができます。したがって、ジェネリック医薬品の使用の促進により、医療の質を落とすことなく、患者さんの薬剤費の自己負担を軽減することができるほか、革新的新薬の創出など、新たに求められる治療に対して限られた医療費資源を振り向けることも可能となるのです。
 世界で最も優れていると言われる日本の医療保険制度を、今後も持続させていくためにはどうすればよいかを検討することは、社会保障政策の中の重要なテーマの一つでありますが、その点において、質を落とすことなく医療資源の効率的活用を図ることができるジェネリック医薬品の果たす役割は、極めて大きいと言うことができます。
世界で最も優れていると言われる日本の医療保険制度を、今後も持続させていくためにはどうすればよいかを検討することは、社会保障政策の中の重要なテーマの一つでありますが、その点において、質を落とすことなく医療資源の効率的活用を図ることができるジェネリック医薬品の果たす役割は、極めて大きいと言うことができます。

 有効性・安全性は?
有効性・安全性は?ジェネリック医薬品の承認審査の際に求められる試験項目は、先発医薬品(新薬)の場合と比べて非常に少ない。だから、ジェネリック医薬品は、先発医薬品と比べて有効性や安全性の面で劣るのではないか?
 ジェネリック医薬品の審査の際に省略される試験項目は、先発医薬品において既に確認済の内容であり、試験項目が先発医薬品と比べて少なくても、先発医薬品と同等の有効性や安全性を有すると判断することができます。これは、米国や欧州の各国でも同様であり、最新の科学的知見に基づく世界標準の考え方です。
ジェネリック医薬品の審査の際に省略される試験項目は、先発医薬品において既に確認済の内容であり、試験項目が先発医薬品と比べて少なくても、先発医薬品と同等の有効性や安全性を有すると判断することができます。これは、米国や欧州の各国でも同様であり、最新の科学的知見に基づく世界標準の考え方です。
 医薬品の有効性、安全性を確認するために必要となる試験項目は、「有効成分に関する試験」と「製剤化された医薬品に関する試験」の大きく2つに分けられます。
医薬品の有効性、安全性を確認するために必要となる試験項目は、「有効成分に関する試験」と「製剤化された医薬品に関する試験」の大きく2つに分けられます。先発医薬品の承認審査の際には、毒性試験や薬理作用の試験及び治験と呼ばれる臨床試験等により、その医薬品の主成分(有効成分)と製剤の有効性や安全性の確認がなされています。一方、ジェネリック医薬品については、添加剤は異なるものの主成分そのものは先発医薬品と同じですので、主成分の有効性や安全性は、こうした「有効成分に関する試験」や、先発医薬品の市販後調査のデータにより、既に確認がなされています。
あとは「製剤化された医薬品に関する試験」のデータにより、先発医薬品と同じ有効成分を同一量含有するジェネリック医薬品が、先発医薬品と同様の血中濃度推移を示すことが確認できれば、医薬品としての作用の強さや影響は同じということになり、治療効果すなわちヒトにとっての有効性や安全性は、先発医薬品と同等であると判断することができます。この判断を行うための試験が、生物学的同等性試験です
このように、ジェネリック医薬品の試験項目が先発医薬品と比べて少なくても、先発医薬品と同等の有効性や安全性を有すると判断することができます。こうした考え方は日本だけのものではなく、米国や欧州の各国でも同様であり、最新の科学的知見に基づく世界標準の考え方です。
また、先発医薬品であっても、添加剤を変更する際や、口腔内崩壊錠などを追加で上市する際に必要となる承認審査については、「有効成分が同じで添加剤が変わる」という位置づけであり、求められる試験項目および基準は、ジェネリック医薬品と同じです。
 ジェネリック医薬品の承認審査の際に求められる試験項目が先発医薬品よりも少ないがゆえに、その品質等が不安だと指摘されることがありますが、もし本当に承認審査の際に求められる試験項目に問題があるとすれば、ジェネリック医薬品の承認基準によって承認された先発医薬品についても問題があることになります。ジェネリック医薬品の試験項目が少ないことに問題があるというのは全くの誤解であり、先発医薬品とジェネリック医薬品のどちらも、有効性や安全性が確認されたもののみが承認されているのです。
ジェネリック医薬品の承認審査の際に求められる試験項目が先発医薬品よりも少ないがゆえに、その品質等が不安だと指摘されることがありますが、もし本当に承認審査の際に求められる試験項目に問題があるとすれば、ジェネリック医薬品の承認基準によって承認された先発医薬品についても問題があることになります。ジェネリック医薬品の試験項目が少ないことに問題があるというのは全くの誤解であり、先発医薬品とジェネリック医薬品のどちらも、有効性や安全性が確認されたもののみが承認されているのです。

 海外の粗悪な原薬の使用は?
海外の粗悪な原薬の使用は?ジェネリック医薬品の原薬は海外の粗悪なものを使っているのではないか?
 有効性及び安全性において先発医薬品と異なる影響を与えるような純度の低い粗悪な原薬による製剤が、ジェネリック医薬品として承認されることはありません。
有効性及び安全性において先発医薬品と異なる影響を与えるような純度の低い粗悪な原薬による製剤が、ジェネリック医薬品として承認されることはありません。
 万が一、純度の低い粗悪な原薬が製剤にそのまま使用されているとすれば、その医薬品の有効性や安全性に悪い影響を及ぼすこともあり得るでしょう。
万が一、純度の低い粗悪な原薬が製剤にそのまま使用されているとすれば、その医薬品の有効性や安全性に悪い影響を及ぼすこともあり得るでしょう。しかし実際には、承認審査の段階で、原薬及び製剤それぞれの品質がともに先発医薬品の品質と同等あるいはそれ以上であるかどうかを審査するとともに、製剤の生物学的同等性が保証されているかどうかを審査し、問題のない医薬品のみが承認されています。
また、原薬の純度に関する審査にあたっては、日米EU医薬品規制調和国際会議(ICH)の合意に基づく「新有効成分含有医薬品のうち原薬の不純物に関するガイドライン」を、ジェネリック医薬品についてもそのまま準用しています。
したがって、有効性及び安全性において先発医薬品と異なる影響を与えるような純度の低い粗悪な原薬による製剤が、ジェネリック医薬品として承認されることはありません。
 なお、海外からの輸入による原薬は、ジェネリック医薬品だけに使われているわけではなく、先発医薬品として使われているものもあります。独立行政法人医薬品医療機器総合機構(PMDA)のホームページで公開されている原薬等登録原簿(MF)には、平成23年3月末の時点で約40か国の原薬メーカーの登録がなされています。
なお、海外からの輸入による原薬は、ジェネリック医薬品だけに使われているわけではなく、先発医薬品として使われているものもあります。独立行政法人医薬品医療機器総合機構(PMDA)のホームページで公開されている原薬等登録原簿(MF)には、平成23年3月末の時点で約40か国の原薬メーカーの登録がなされています。

 品質管理の基準は?
品質管理の基準は?ジェネリック医薬品メーカーは、先発医薬品メーカーと比べて1社あたりの製造販売品目が多いので、各品目に対する品質管理が不十分になるのではないか?
 先発医薬品メーカー、ジェネリック医薬品メーカーを問わず、すべての医薬品は、GMP基準(医薬品及び医薬部外品の製造管理及び品質管理に関する基準)等に適合した工場でしか製造が許されていません。
先発医薬品メーカー、ジェネリック医薬品メーカーを問わず、すべての医薬品は、GMP基準(医薬品及び医薬部外品の製造管理及び品質管理に関する基準)等に適合した工場でしか製造が許されていません。
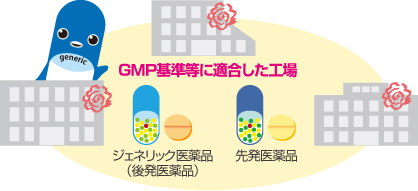 医薬品が製造販売承認を得るためには、その製造所での製造がGMP基準(医薬品及び医薬部外品の製造管理及び品質管理に関する基準)に適合していなければなりません。先発医薬品メーカー、ジェネリック医薬品メーカーを問わず、全ての医薬品は、共通のGMP等の基準を満たした製造所でのみ製造が許されていることになります。
医薬品が製造販売承認を得るためには、その製造所での製造がGMP基準(医薬品及び医薬部外品の製造管理及び品質管理に関する基準)に適合していなければなりません。先発医薬品メーカー、ジェネリック医薬品メーカーを問わず、全ての医薬品は、共通のGMP等の基準を満たした製造所でのみ製造が許されていることになります。GMP等の基準の遵守状況についても、各都道府県に配置された薬事監視員等による定期的な査察により、チェックがなされています。
また、製造された医薬品製剤のサンプルは保存され、出荷後、定期的に品質の変化をチェックすることも行われています。さらに、都道府県等の協力のもと実施している医薬品等一斉監視指導において、実際に市場に流通しているジェネリック医薬品を入手し、溶出試験等の品質検査により重点的にチェックを行い、その結果を年度ごとに取りまとめて公表しています。
 なお、現行の薬事法では、医薬品の承認を取得した製造販売業者が別の業者に製造を委託することが可能です。先発医薬品であっても、製造委託により、実際にはジェネリック医薬品メーカーの工場で製造が行われることもあります。
なお、現行の薬事法では、医薬品の承認を取得した製造販売業者が別の業者に製造を委託することが可能です。先発医薬品であっても、製造委託により、実際にはジェネリック医薬品メーカーの工場で製造が行われることもあります。もちろん、GMP等はあくまでも医薬品を製造管理・品質管理するための「基準」であり、当然のことながら、全ての医薬品メーカーが高いモラルを持って絶えず品質管理の努力とスキル向上を徹底することが重要になります。

 薬価が安い理由は?
薬価が安い理由は?先発医薬品とジェネリック医薬品が同等であるならば、なぜジェネリック医薬品の薬価は安いのか。やはり、品質が劣るからではないのか?
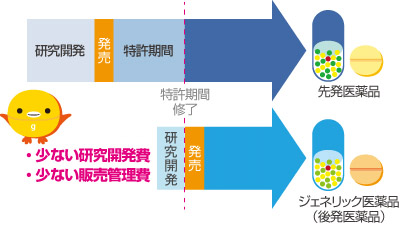
 ジェネリック医薬品の薬価が安いのは、品質が劣るからではなく、研究開発費等が先発医薬品ほどかからないためです。
ジェネリック医薬品の薬価が安いのは、品質が劣るからではなく、研究開発費等が先発医薬品ほどかからないためです。
 ジェネリック医薬品が安いからといって、先発医薬品と比べて品質が劣るわけではありません。
ジェネリック医薬品が安いからといって、先発医薬品と比べて品質が劣るわけではありません。ジェネリック医薬品は先発医薬品の長年にわたる臨床使用経験等を踏まえて開発、製造されます。したがって、ジェネリック医薬品の承認審査にあたっては、先発医薬品ほど多くの試験項目は必要とはなりません。そのために、研究開発に要する費用が少なくて済むのです。新薬開発に要する費用が、1品目300億円以上といわれるのに対して、ジェネリック医薬品の場合は、1億円程度に収まっているようです。
 また、ジェネリック医薬品は、先発医薬品の使用経験により、有効性や安全性に関する評価が既にある程度確立していますので、情報提供等に関する販売管理費も少なくなります。こうした理由により、低価格での提供が可能となります。
また、ジェネリック医薬品は、先発医薬品の使用経験により、有効性や安全性に関する評価が既にある程度確立していますので、情報提供等に関する販売管理費も少なくなります。こうした理由により、低価格での提供が可能となります。先発医薬品(新薬)を開発するためには、研究開発等に莫大なコストを要します。先発医薬品の薬価には、研究開発等に要するコスト相当分を含んでいると言うことができます。